Du kan bli skyldig att skriva elektron konfiguration av en atom på en kemi prov, men det är lättare än det verkar. Här är hur du kommer igång.
Steg
- 1Bestäm antalet elektroner i atomen. Den atomnummer (på periodiska systemet) är antalet protoner i atomen, och därmed lika med antalet elektroner i en atom med noll.
- 2Om du arbetar med en laddad atom, lägga till eller dra ifrån elektroner därefter. Till exempel en natriumatom med en negativ laddning en skulle ha en annan elektron utöver den atomnummer 11, vilket gör 12 elektroner.
- 3Memorera grundläggande lista över orbitaler. När du vet ordningen på orbitaler, kan du fylla dem helt enkelt beroende på antalet elektroner i atomen.
- Den s omloppsbanor set (varje tal följt av ett "s") innehåller en enda omloppsbanor, och av Paulis exklusion, kan en enda orbital rymmer maximalt 2 elektroner, så varje s orbital set rymmer 2 elektroner.
- Den p orbital set innehåller 3 orbitaler, och därmed kan hålla totalt 6 elektroner.
- Den d orbital set innehåller 5 orbitaler, så det kan hålla 10 elektroner.
- Den f orbital set innehåller 7 orbitaler, så det kan hålla 14 elektroner.
- Memorera ordningen på orbitaler. Observera att omloppsbanor set numreras av elektron skal, men beställde i fråga om energi. Till exempel är en fylld 4s 2 lägre energi (eller mindre potentiellt instabil) än en delvis fyllda eller fyllda 3d 10, så det 4s skalet listas först.
- 4Lägg en elektron i den högsta energin orbital tillgängliga, med början 1s (innehar högst två elektroner). Var försiktig inte fylla orbitaler i den ordning som visas i diagrammet Fyll orbitaler i denna ordning (numret efter orbital uppsättningen är det maximala antalet elektroner kan det hålla!):
- 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6
- Observera att ovanstående lista, om alla skalen fylldes, skulle vara den elektron konfiguration för UUO (Ununoctium), 118, den högsta numrerade atom på periodiska systemet - så denna elektron konfiguration innehåller alla för tillfället kända elektron skal för ett laddat neutralt atom.
- Obs: energinivå ändras när du går upp. Till exempel, när du är på väg att gå upp till 4: e energinivå, blir det 4s först, sedan 3d. Efter den fjärde energinivå, kommer du gå vidare till 5: e där det följer ordningen igen. Detta sker endast efter 3: e energinivå.
- 5Fyll i orbitaler enligt antalet elektroner i atomen.
Alternativ metod
Det finns en alternativ metod för att skriva elektronkonfigurationer som kräver varken memorering eller mnemoniska diagram. Det kräver dock ordnas periodiska systemet, eftersom det i traditionell periodiska systemet, som börjar med fjärde raden, inte överensstämmer period siffrorna inte de elektron skal.
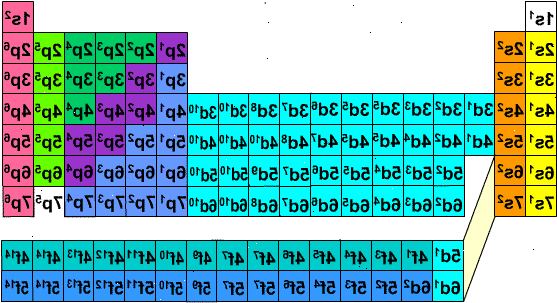
I Adomah periodiska systemet, designad av V. Tsimmerman, horisontella rader representerar grupper av element, såsom halogener, ädelgaser, alkalimetaller, alkaliska jordartsmetaller, etc. vertikala kolumner motsvarar elektron skal och så kallade "kaskader" motsvarar perioder (när diagonala linjer som förbinder s, p, d och f block följs). Helium flyttas till vätgas, eftersom båda kännetecknas av elektronerna som är belägna i samma orbital. Block av perioder (s, p, d och f) visas på den högra sidan och skal nummer visas vid basen. Element presenteras i rektangulära lådor som är numrerade från 1 till 120. Dessa nummer kallas atomnummer som också representerar totala antalet elektroner i en neutral atom. Detta arrangemang gör att skriva elektronkonfigurationer mycket enkel:
- 1Skriv ut kopia av Adomah periodiska systemet från denna webbplats: ( www.perfectperiodictable.com/Images/Binder1 ). Att skriva elektron konfiguration av ett element, finna sin symbol i Adomah periodiska systemet och stryka alla element som har högre atomnummer. Till exempel, om du behöver skriva elektron konfiguration erbiums (68), stryka element 69 via 120. Kallelse siffrorna 1 till 8 vid basen av tabellen. De är elektronskalet siffrorna eller kolumn. Ignorera kolumner som endast innehåller överstruket element. För Erbium återstående kolumnerna är 1,2,3,4,5 och 6.
- 2Titta på blocket symboler som visas på höger sida av bordet (s, p, d, och f) och vid kolumnnumren visas vid basen och ignorera diagonala linjer mellan blocken, bryta upp kolumner i kolonn-block och lista dem i ordning från botten upp. Återigen, ignorera kolumnen block där alla delar är överstruken. Skriv ned kolumn-block börjar med kolonnen följt av blocket symbolen, så här: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (vid erbiums). Se not nedan. *
- 3Räkna element som inte korsades i varje block-kolumn och skriv ner deras kvantitet bredvid blocket symboler för varje block-kolumn, så här: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 12 5s 2 5p 6 6s 2. Det är den elektron konfiguration erbiums. (Se nedan).
- 4Det finns arton vanliga undantag elektronkonfigurationer för atomer i det lägsta energitillståndet, även kallad grundtillståndet. De avviker från den allmänna regeln endast genom sista två-till-tre elektron positioner. Här är de: Cr (..., 3D5, 4S1), Cu (..., 3D10, 4S1), Nb (..., 4D4, 5s1), Mo (..., 4D5, 5s1); Ru (..., 4d7, 5s1), Rh (..., 4D8, 5s1), Pd (..., 4d10, 5s0), Ag (..., 4d10, 5s1), La (..., 5D1, 6s2), Ce (..., 4F1, 5D1, 6s2), Gd (..., 4f7, 5D1, 6s2), Au (..., 5d10, 6S1), Ac (..., 6d1, 7s2), Th (..., 6D2, 7s2), Pa (..., 5F2, 6d1, 7s2), U (..., 5F3, 6d1, 7s2), Np (..., 5f4, 6d1, 7s2) och Cm (..., 5f7, 6d1, 7s2).
- Anmärkning: Ovanstående elektron konfiguration Er skrivs i ordningen stigande skal siffror. Det kan också vara skriven i den ordning i omloppsbanor fyllning. Följ bara kaskader från topp till botten i stället för kolumner när du skriver ner i kolumnen-block: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 12.
Tips
- Det finns omständigheter när en elektron måste "främjas." När en omloppstid uppsättning är en elektron från att vara fylld till hälften eller helt upptagna, ta bort en elektron från närmaste s eller p orbital set och flytta den till den orbital uppsättning som behöver elektronen.
- När atomen är en jon, betyder det att antalet protoner inte vara lika med antalet av elektroner. Laddningen av atomen kommer de att visas längst upp till höger (oftast) hörnet av den kemiska beteckningen. Så, har en antimonatom med laddning +2 en elektron konfiguration 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 1. Observera att 5p 3 ändras till en 5p 1. Var försiktig när konfigurationen av en oladdad atom slutar i något annat än en s och p orbital set. När du tar bort elektroner, kan du bara ta bort dem från valens orbitaler (s och p orbitaler). Så om en konfiguration slutar i 4s 2 3d 7, och atomen vinner en laddning av 2, då konfigurationen skulle ändra för att avsluta med 4s 0 3d 7. Observera att 3D 7 inte ändras, i stället är de s omloppsbanor elektroner förloras.
- Det finns inget sådant som "stabiliteten i en halvfylld" undernivåer. Det är en grov förenkling. Varje stabilitet avser "halv-fyllda" undernivåer beror på det faktum att varje orbital var för sig är upptagen, vilket elektron-elektron repulsioner minimeras.
- Du kan också skriva ett elements elektron konfiguration genom att bara skriva valensen konfiguration, som är den sista s och p orbital set. Så skulle valensen konfigurationen av en antimonatom vara 5s 2 5p 3.
- För att hitta den atomnummer av atomen när den är i elektronkonfiguration form bara lägga upp alla de nummer som följer bokstäverna (s, p, d, och f).
- Skriva långa elektronkonfigurationer kan undvikas genom att skriva dem i deras ädelgas konfigurationer. Använda en elektron konfiguration som är skrivet i storleksordningen orbital fyllning, hitta den sista symbolen innehåller p6 (t.ex. 3p 6 eller 5p 6) och lägga upp alla nummer efter bokstäverna i varje symbol innan och med p6 orbital set. Sedan, med hjälp av summan av talen, lokalisera elementet med atomnummer lika med summan du bara beräknas. Det bör visas längst till höger i det periodiska systemet. Det kallas en ädelgas. Nu, bara ta bort alla symboler som du lagt upp och sätta i ädelgas "symbol inom parentes. Så, för en antimonatom skulle ädelgas konfigurationen [Kr] 5s 2 4d 10 5p 3. Lägg märke till att du inte lägger upp 5s 2 och 4d 10 eftersom de är efter 4p 6, som du lägger till.
- Joner är inte samma sak. De är mycket svårare. Hoppa två nivåer och följer samma mönster beroende på var du startade beroende på hur högt eller hur lågt antalet elektroner är.
- Varje atom önskar att vara stabil, och de mest stabila konfigurationerna har full s och p (S2 och P6) omloppsbanor uppsättningar. De ädelgaser har denna konfiguration, vilket är varför de är sällan reaktiva och är på rätt sida av det periodiska systemet. Så om en konfiguration slutar i 3p 4, behöver den bara två elektroner för att bli stabil (förlora sex, däribland s orbital uppsättningens elektroner, tar mer energi, så förlorar fyra är enklare). Och om en konfiguration slutar i 4d 3, behöver den bara förlora tre elektroner för att nå ett stabilt tillstånd. Också, halv fyllda skal (s1, p3, d5..) är mer stabila då, till exempel p4 eller p2, men kommer s2 och p6 vara ännu mer stabil.
- Det finns två olika sätt att skriva elektronkonfigurationer. De kan skrivas i den ordning stigande skal tal, eller i storleksordningen orbital fyllning, som presenteras ovan för Erbium.
- Numret efter brevet är faktiskt upphöjd, så gör inte det misstaget på ett test.
